Tragödie - Katastrophe - Skandal?
Chronik des Contergan-Falls
Stand: 22.11.2006, 06:00 Uhr
Das Medikament Contergan verwandelte den Traum vom Schlaf ohne Nebenwirkungen in einen Albtraum. Hier die Chronik der wichtigsten Ereignisse im Zusammenhang mit dem Skandal, seinen Folgen und den Konsequenzen daraus.
1955:
Die Universitätsklinik Köln erhält die von Chemie Grünenthal entwickelte Substanz Thalidomid (damals: K17) zur klinischen Prüfung. Der beauftragte Arzt berichtet 1956, der Wirkstoff sei gut verträglich. Er hatte ihn in Tablettenform an mehr als 300 Patienten verabreicht. Auch Ärzte anderer Unikliniken beurteilen Thalidomid in ihren Berichten positiv. An Schwangeren wird der Wirkstoff nicht getestet.
10. Juli 1956:
Die Gesundheitsabteilung des NRW -Innenministeriums genehmigt die Abgabe thalidomidhaltiger Arzneimittel. Ein öffentlich-rechtliches Verfahren zur Zulassung von Arzneimitteln existiert noch nicht.
November 1956:
Unter dem Name „Grippex“ bringt Grünenthal ein Medikament auf den Markt, das gegen Grippe helfen soll. Darin wird, neben weiteren Wirkstoffen, erstmals auch Thalidomid verwendet.
1. Oktober 1957:
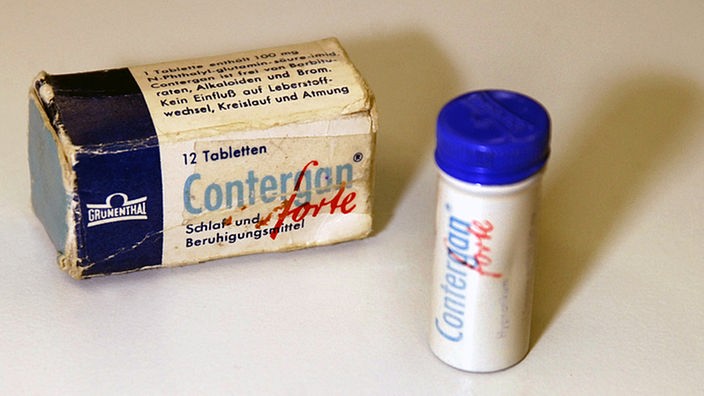
Grünenthal bringt bundesweit Contergan und Contergan forte in den Handel. Das Beruhigungs- und Schlafmittel ist in Apotheken rezeptfrei erhältlich. Thalidomid wird in mehr als 40 Länder exportiert.
3. Oktober 1959:
Der Neurologe Ralf Voss fragt bei der Firma Grünenthal an, ob Thalidomid bei längerer Einnahme toxische Wirkung auf Nerven haben könnte. Bis Ende November 1961 wird Grünenthal von ungefähr 1.500 Apotheker und Ärzte über etwa 3.000 Fälle von Nervenschädigungen informiert. Hinzu kommen Beschwerden von mehr als 300 Verbrauchern.
30. April/1. Mai 1960:
Auf einem Neurologen-Kongress in Düsseldorf berichtet der Neurologe Ralf Voss über die Nervenschädigungen, die seinen Beobachtungen zufolge durch Thalidomid verursacht werden. Die Forschungsabteilung von Grünenthal versucht daraufhin, die Nervenschädigungen an Ratten zu reproduzieren - ohne Erfolg. Grünenthal-Forschungsleiter Mückter schließt daraus, dass es sich um besondere Situationen handelt, für die Contergan nur selten als Ursache infrage kommt.
12. September 1960:
Der US-Arzneimittelhersteller Richardson-Merrell beantragt bei der amerikanischen Gesundheitsbehörde die Zulassung eines thalidomidhaltigen Medikaments namens Kevadon. Die Zulassung wird nicht erteilt. Die zuständige Ärztin, Frances Kathleen Oldham Kelsey, hat Sicherheitsbedenken und fordert weitere Untersuchungen, auch zum Einfluss des Wirkstoffs auf das ungeborene Leben.
Oktober 1960:
In einigen Krankenhäusern werden Thalidomid-Präparate aufgrund der beobachteten Nebenwirkungen von der Liste der verwendeten Arzneimittel gestrichen.
24. November 1960:
Ein Apotheker fragt bei der Firma Grünenthal schriftlich an, ob die Einnahme von Thalidomid während der Schwangerschaft zu Kindesmissbildungen führen kann. Im gleichen Monat nimmt Grünenthal einen Hinweis auf Nervenstörungen nach längerfristiger Einnahme von Contergan und Contergan forte in die Gebrauchsanweisung auf. Dabei wird versichert, die "Überempfindlichkeitserscheinungen" seien reversibel, wenn man die Einnahme der Arznei sofort beende. Das erweist sich als falsch.
15. Februar 1961:
Voss führt auf einem Neurologen-Kongress in Düsseldorf erneut Nervenschädigungen auf Thalidomid zurück und erklärt, er rechne damit, dass diese Schäden nicht reversibel sind.
26. Mai 1961:
Grünenthal beantragt bei der Gesundheitsabteilung des NRW-Innenministeriums die Rezeptpflicht für Thalidomid. Kurz zuvor waren drei Publikationen über Nervenschädigungen durch die Substanz erschienen.
24. Juni 1961:
Das Bundesgesundheitsamt empfiehlt, die Rezeptpflicht für Thalidomid einzuführen.
1. August 1961:
Thalidomid wird durch Landesverordnung in Nordrhein-Westfalen, Hessen und Baden-Württemberg verschreibungspflichtig. In den anderen Bundesländern ist es nach wie vor ohne Rezept erhältlich. Das erste Arzneimittelgesetz der Bundesrepublik Deutschland tritt in Kraft.

Firma Grünenthal um 1965
16. August 1961:
Das Nachrichtenmagazin "Der Spiegel" veröffentlicht unter dem Titel "Zuckerplätzchen forte" einen Bericht über die beobachteten Nervenschäden durch Thalidomid. Der Umsatz mit Contergan bricht drastisch ein. Im August 1961 zahlt der Grünenthal an Patienten mit Nervenschädigungen, die von der Firma Schadensersatz verlangten, Beträge von 200 bis 20.000 Mark.
September 1961:
Der Direktor der Städtischen Kinderkliniken in Krefeld berichtet in "Die Medizinische Welt", dass die Gliedmaßenmissbildungen bei Neugeborenen zugenommen hätten. Es ist die erste Publikation über die Missbildungswelle in Deutschland.
15. November1961:
Der Hamburger Kinderarzt und Humangenetiker Widukind Lenz unterrichtet den Forschungsleiter der Firma Grünenthal telefonisch, dass er Contergan verdächtigt, bei der Einnahme während der Schwangerschaft zu Kindesmissbildungen zu führen. Lenz fordert, alle Thalidomid-Präparate aus dem Handel zu nehmen.
24. November 1961:
Auch bei einer Besprechung im Düsseldorfer Innenministerium wird Grünenthal aufgefordert, alle Thalidomid-Präparate sofort vom Markt zu nehmen. Die Firma lehnt das ab. Sie droht statt dessen damit, das Ministerium für den finanziellen Schaden haftbar zu machen.
25. November 1961:
Das NRW-Innenministerium unterrichtet die Gesundheitsbehörden der Bundesländer, das Bundesgesundheitsamt, das Bundesinnenministerium sowie die Ärzte-, Zahnärzte und Apothekerkammern über den neuen Verdacht gegen Thalidomid.
26. November 1961:
Die Zeitung "Welt am Sonntag" veröffentlicht den Artikel "Missgeburten durch Tabletten? Alarmierender Verdacht eines Arztes gegen ein weitverbreitetes Medikament".
27. November 1961:
Die Firma Grünenthal kündigt in einem Telegramm an das Düsseldorfer Innenministerium an, ihre Thalidomid-Präparate im In- und Ausland sofort aus dem Handel zu nehmen.
30. November 1961:
Eine Sachverständigen-Kommission, die das NRW-Innenministerium eingerufen hat, kommt zusammen. Die Experten erklären es für wahrscheinlich, dass Thalidomid Missbildungen hervorruft.
Das amerikanische Arzneimittelunternehmen Richardson-Merrell informiert die US-Gesundheitsbehörde über die Ereignisse in Deutschland und zieht vier Monate später seinen Antrag auf Zulassung von Thalidomid zurück.
1. Dezember 1961:
Ein Patient, der seine Nervenschäden auf eine Langzeitmedikation mit Contergan zurückführt, stellt bei der Staatsanwaltschaft Hannover Strafanzeige gegen die Firma Grünenthal.
18. Dezember 1961:
Die Staatsanwaltschaft Aachen, die den Fall übernommen hat, setzt ein Ermittlungsverfahren gegen die Firma Grünenthal in Gang.

Ankläger geben Medien Auskunft
4. Juli 1962:
Mitarbeiter der Staatsanwaltschaft Aachen suchen zum ersten Mal die Firma Grünenthal auf. Deren Angehörige bestreiten weiterhin einen Zusammenhang zwischen der Thalidomid-Einnahme während der Schwangerschaft und den Missbildungen bei Kindern.
Inzwischen ist auch das Ausmaß der Katastrophe sichtbar: Zwischen 1958 und 1962 werden allein in Deutschland etwa 4.000 Kinder mit Missbildungen geboren, von denen 2.800 überleben.
November 1964:
Drei Jahre nach dem Verkaufsstopp stellt ein israelischer Arzt durch Zufall fest, dass Thalidomid schmerzhafte Begleiterscheinungen der Lepra unterdrücken oder zumindest abschwächen kann.
13. März 1967:
Die Staatsanwaltschaft Aachen reicht Klage gegen den führenden Gesellschafter sowie acht leitende Mitarbeiter der Firma Grünenthal beim Landgericht Aachen ein. Bis April 1968 schließen sich mehr als 400 Geschädigte als Nebenkläger an.
27. Mai 1968:
Im Kasino der Grube "Anna" in Alsdorf beginnt der Contergan-Prozess. Sieben Grünenthal-Mitarbeiter stehen vor Gericht. Die Anklage wirft ihnen fahrlässige Tötung, fahrlässige und vorsätzliche Körperverletzung sowie Vergehen gegen das Arzneimittelgesetz vor. 20 Rechtsanwälte der Verteidigung stehen drei Staatsanwälten gegenüber. Sieben weitere vertreten die Nebenkläger.
26. Januar 1970:
Die Firma Grünenthal erklärt sich zur Zahlung von 100 Millionen Mark bereit - wenn damit alle weiteren Forderungen an das Unternehmen und die Angeklagten ausgeschlossen werden.
10. April 1970:
Grünenthal und Vertreter der deutschen contergangeschädigten Kinder vereinbaren einen Vergleich mit Entschädigungen. Darin wird unter anderem festgelegt, die Auszahlungen an die Berechtigten so lange auszusetzen, bis die Eltern und gesetzlichen Vertreter aller betroffenen Kinder die Abfindungserklärung unterschrieben haben.
18. Dezember 1970:
Auch mit Blick auf die Tatsache, dass die finanzielle Lage der geschädigten Kinder gesichert scheint, wird der Contergan-Prozess eingestellt - ohne dass ein Urteil gefällt wird. Das Gericht sieht die Angeklagten zudem als nur geringfügig schuldig an. Das Verfahren ging über 283 Verhandlungstage. 29 Sachverständige und 352 Zeugen sagten aus.
März 1971:
In Los Angeles wird ein Schadensersatzprozess gegen Richardson-Merrell eröffnet, der als einziger weltweit mit einem Urteil endet. Das Gericht spricht der Mutter einer contergangeschädigten Tochter 250.000, dem Kind selbst 2,5 Millionen Dollar Entschädigung zu. Noch bevor über einen Antrag auf Berufung entschieden werden kann, einigen sich beide Parteien auf einen Vergleich.
31. Oktober 1972:
Das Gesetz zur Errichtung einer Stiftung "Hilfswerk für behinderte Kinder" tritt in Kraft. Durch die Einrichtung der Stiftung wird der Vergleich ungültig.
April 1974:
Der Patentschutz für Thalidomid läuft ab. Andere Firmen können die Substanz nun ohne Genehmigung von Grünenthal produzieren.
1. Januar 1978:
Das "Gesetz zur Neuordnung des Arzneimittelrechts" von 1976 tritt in Kraft. Es entsteht unter dem Eindruck der Contergan-Tragödie. Insbesondere die Anforderungen für die Herstellung und Zulassung eines Medikaments werden drastisch verschärft.
Juni 1993:
Ein britisches Fernsehteam berichtet, dass in Brasilien thalidomidgeschädigte Kinder geboren werden. Ihre Mütter hatten das Medikament eingenommen, weil sie es für Verhütungsmittel hielten oder Angst hatten, wegen ihrer Leprakrankheit ins soziale Abseits zu geraten.
Juli 1998:
Die amerikanische Gesundheitsbehörde lässt Thalidomid zur Behandlung der Leprareaktion (Erythema nodosum leprosum) zu. Allerdings nur mit tiefgreifenden Auflagen bei der Verschreibung und Verhütung.
